
9月27日,由北京市知识产权公共服务中心主办,北京知识产权司法保护研究会承办的“生物医药企业海外知识产权保护研讨”活动以线上线下相结合的形式成功举办。
主题分享环节,百济神州知识产权总监王菲老师以“不同国家专利链接制度、专利权期限补偿制度特点及应用”为主题进行了分享。
以下为嘉宾发言要点,由北京知识产权司法保护研究会根据嘉宾发言内容整理。

一、药品专利连接制度的特点和应用
关于药品专利链接制度的特点和应用,王菲老师主要从药品专利链接制度介绍,制度起源,各国药品专利争议解决制度的要点,各国专利链接机制的适用,中国药品专利纠纷早期解决机制及要点、应用展开。
药品专利链接制度是指仿制药上市批准与创新药品专利期满相“链接”,即仿制药注册申请应当考虑先前已上市药品的专利状况,从而避免可能的专利侵权。
药品专利链接制度的作用,一是强化药品注册和药品专利审批机制衔接机制,减少药品专利侵权诉讼。二是加快仿制药准入,减少患者医疗费用的负担。
(一)美国专利链接制度——制度起源
专利链接制度诞生于美国1984年的Hatch-Waxman Act法案(Drug Price Competition and Patent Term Restoration Act),其构建了由原研药专利信息登记的桔皮书制度、仿制药上市申请时四类声明、遏制期和首仿药市场独占期等制度。
根据Hatch-Waxman法案规定,仿制药企业商在递交ANDA时,必须依照橙皮书的规定,递交以下四种声明之一:第I段声明(PI):该药品无专利;第II段声明(PII):该药品有专利,但该专利已经失效;第III段声明(PIII):在相关专利失效前,不要求FDA批准该仿制药;第IV段声明(PIV):与申请的仿制药相关的专利是无效的(策略1)或者仿制药不侵权(策略2)。
PIV声明的ANDA是典型的仿制药挑战专利,PIV声明即为挑战书。含PIV专利挑战的产品是可以在NCE-1(即NDA批准日期满48个月后的第一天)递交ANDA的,这一天通常被称为“首仿日”,如果在这一天有多家仿制药企业递交ANDA,那么在专利挑战成功后,它们将共同拥有180天的市场独占期。
(二)各国药品专利争议解决机制的要点
各国药品专利争议解决机制的要点中,中国、美国、加拿大、韩国、日本有专利链接制度,欧盟各国和印度没有专利链接制度。
基于各个国家不同的产业政策,其也会对自己国家相应的专利链接制度或者专利争议解决制度制定相应的法律政策,对于争议的解决时间,中国、美国、加拿大、韩国、倾向于在药品上市前解决争议,日本是药品上市前或者药品进入医保前解决争议,而欧盟各国和印度则是在上市后来解决专利争议。
各个国家的争议解决方式也有差异,中国属于类拟制侵权,这不是真正意义上的拟制侵权,或者通过司法或行政确认,即向国家知识产权局请求裁决或者向知识产权法院请求判定仿制药是否落入原研药品所登记的专利的保护范围内。美国采用拟制侵权的争议解决方式,所谓拟制侵权是将原来不属于侵权行为的提交注册行为拟制为侵权。加拿大目前也倾向于采用拟制侵权的争议解决方式,韩国采用类拟制侵权和行政确认双重方式,日本采用进入医保前的事前协调,欧盟国家和印度采用侵权诉讼和禁令方式解决争议[1]。
(三)各国专利链接机制的适用
在中国、美国、加拿大、韩国中,适用专利链接制度也有所差异。在适用范围上,中国的适用范围为化学药品、生物制品以及中药,美国的适用范围仅限于化学药品,加拿大的适用范围为化学药品、生物制品,韩国的适用范围也为化学药品、生物制品。
针对起诉期限,各国起诉期限基本均是45天。
仿制药审批等待期(遏制期)各国之间有所不同,中国的遏制期是9个月,美国遏制期是30个月,加拿大遏制期是24个月并且可以放弃,韩国遏制期是非自动中止9个月,遏制期内不影响审批,但不得上市。
各国在首挑成功仿制药市场独占期上,中国是12个月,美国180天,加拿大没有首仿独占期但有权请求赔偿,韩国是9个月。中国给出的市场独占期最长,但同时提出的要求也相对较高。需要是首个获批、首个挑战成功的“双首”,目前在实践中尚未有仿制药获得12个的独占期。
对于专利链接制度的专利类型,各个国家也有所不同。中国适用范围有三类药,对于三类药物的专利类型具有不同的规定。化学药是包括药物活性成分化合物专利、含活性成分的药物组合物专利、医药用途专利;中药是包括中药组合物专利、中药提取物专利、医药用途专利;生物制品是包括活性成分的序列结构专利、医药用途专利。美国专利类型包括活性成分、产品、或使用方法与适应症专利。加拿大专利类型包括活性成分、剂型、医药用途专利。韩国专利类型则包括有效成分、药物剂型、药物组合物、药物用途专利。
(四)中国药品专利纠纷早期解决机制
中国药品专利纠纷早期解决机制,立法本意是将相关药品上市审批程序与相关药品专利纠纷解决程序相衔接,保护药品专利权人合法权益,降低仿制药上市后专利侵权风险。
中国专利法第76条(生效日为2021年6月1日)规定:药品上市审评审批过程中,因注册药品相关的专利权产生纠纷的,当事人可以向人民法院起诉或向国务院专利行政部门请求行政裁决,请求就申请注册的药品的相关技术方案是否落入他人药品专利权保护范围做出判决/裁决,国务院药品监督管理部门可以根据生效判决/裁决作出是否暂停批准相关药品上市的决定。
配套措施包括最高人民法院发布的《最高人民法院关于审理申请注册的药品相关的专利权纠纷民事案件适用法律若干问题的规定》(2021年7月5日),国家药品监督管理局和国家知识产权发布的《药品纠纷早期解决机制实施办法(试行)》(2021年7月4日),国家知识产权局发布的《药品专利纠纷早期解决机制行政裁决办法》(2021年7月5日)
(五)中国药品专利纠纷早期解决机制的要点
中国药品专利纠纷早期解决机制的要点可以概括为一项纠纷、两条路径、三个部门和四类声明。一项纠纷是指相关技术方案是否落入他人药品专利权保护范围;两条路径是指司法途径(知识产权法院)和行政途径(国家知识产权局),两条途径可以二选一,不同的途径策略上会有不同;三个部门职能分别是指药监部门的审批事宜,人民法院和知识产权局确认相关技术方案是否落入他人药品专利权保护范围;四类声明分别是:1.登记平台中没有被仿制药的相关专利信息,2.被仿制药专利已终止/被宣告无效或仿制药申请人获得专利许可,3.登记平台收录有被仿制药相关专利,仿制药申请人承诺届满前不上市,4.被仿制药相关专利应当被无效(4.1)或者仿制药未落入专利的保护范围(4.2)。
(六)中国药品专利纠纷早期解决机制的应用
通过知产宝数据库对中国药品专利纠纷早期解决机制的情况查询,截至到9月25日,专利声明共2723项(化学药品2685项,生物制品38项),声明类型中,1类声明2239;2类声明146;3类声明227;4.1类声明44;4.2类声明107。
通过公开的数据查询到的行政裁决案件情况(9月25日),对外公布的行政裁决案件共涉及16件专利,11款药品,11家原研药,10家仿制药企业。涉及24个4.1类声明,4个4.2类声明。共涉及15个结案通知书(5驳回,10主撤),13个裁决书(8个落入专利权保护范围,5个未落入专利权保护范围)。
二、药品专利期限补偿制度的特点和展望
药品专利期限补偿制度的特点和展望主要从药品专利期限补偿机制,各国药品专利期限补偿机制对比,中国药品专利期限补偿机制,中国药品专利期限补偿机制的特点及应用展开。
(一)药品专利期限补偿机制
药品专利期限补偿机制是为了弥补创新药为获批上市而造成的有效专利期(从产品上市起的市场独占期)的损失而适当增加专利保护期限的制度,主要是补偿因漫长的临床试验以及药品审批流程所耗费的大量时间。
该制度也来源于1984年Hatch-Waxman法案,自1984年以来,美国、欧盟、日本、澳大利亚、以色列、韩国、俄罗斯以及中国等均建立了专利期补偿制度。
(二)各国药品专利期限补偿机制对比
以中国、美国、欧盟和日本为例,各国建立药品专利期限补偿机制的目的有所不同,对于中国来说是为了补偿新药上市审评审批占用的时间;美国是为了平衡产业发展,一是平衡Bolar例外,二是未能及时实施专利的时间损失;欧盟主要是为了激励“新活性成分”的早期研发,激励可成药的研发以及在国际竞争格局中保持领先;日本主要是为了补偿未能及时实施专利带来的时间损失。
不同国家药品专利期限补偿机制对于“新药”的定义不同。中国目前尚未确定是否适用全球新,相关配套的法律法规尚未发布,例如专利法实施细则以及专利指南,但是从雏形中可以看出似乎要把“新药”定义为全球新,即需要是国内外的首次获批,目前关于这一点也引起的业内广泛的讨论。美国、欧盟和日本对“新药”的定义均是要求本地新。
各国之间的药品专利补偿期限的补偿期差异较大。对于中国来说PTE时间是药品上市获得批准日减去专利申请日再减去5年,PTE总时间不能超过5年,并且总专利期限不能超过14年。美国PTE时间是试验阶段耗时的1/2,加上审批阶段耗时,减去未尽职责的时间,PTE总时间不超过5年,总专利期限不能超过14年。欧盟SPC时间是欧盟首次获批日减去专利申请日再减去5年,补偿期不能超过5年,第一次获批总专利期限不超过15年。日本PTE时间则是药品上市批准日减去临床试验开始的日期或者专利登记的日期开始计算(以在后日期为准),PTE不超过5年。
各国药品专利期限补偿机制中的延长个数中,中国是一个专利仅补偿一次,一个药品仅补偿一次,新适应症可获得补偿。美国是一个专利仅补偿一次,一个药品仅补偿一次,仅补偿药品首次上市,新适应症不可补偿。欧盟同美国类似,但是近期有多次补偿的趋势。日本一个专利可补偿多次,一个药品可补偿多次。
(三)中国药品专利期限补偿机制
中国药品专利期限补偿机制的立法本意是为了鼓励创新药尽早进入我国市场,满足我国用药需求;同时提高制药产业创新能力,实现由“仿”到“创”的战略转移。
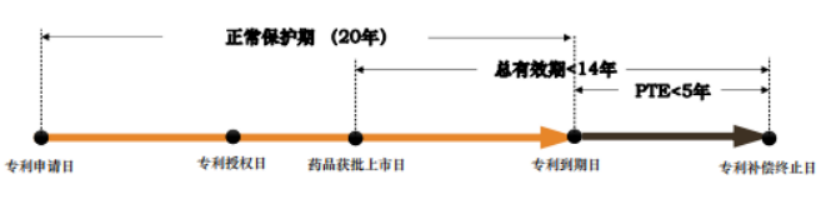
为补偿新药上市审评审批占用的时间,对在中国获得上市许可的新药相关发明专利,给予专利权期限补偿。补偿期限不超过五年,新药批准上市后总有效专利权期限不超过十四年。(中国专利法第42条)2021年6月1日相关法律正式实施,配套实操规定尚在拟定中。
(四)中国药品专利期限补偿机制的特点
中国药品专利期限补偿机制中最值得关注的是“新药”的范畴。《专利审查指南修改草案(征求意见稿)》中把新药定义为国务院药品监督管理部门批准上市的创新药和符合规定的改良型新药。创新药和改良型新药的含义依照相关法律法规并参照国务院药品监督管理部门的相关规定确定。
《专利审查指南修改草案(征求意见稿)》中,改良型新药主要包括:(1)化学药品第2.1类中对已知活性成份成酯,或者对已知活性成份成盐的药品;(2)化学药品第2.4类,即含有已知活性成份的新适应症的药品;(3)预防用生物制品2.2类中对疫苗菌毒种改进的疫苗;(4)治疗用生物制品第2.2类中增加新适应症的生物制品;(5)中药第2.3类,即增加功能主治的中药。
创新药包括1类新药(化学药、预防生物制品、治疗生物制品、中药),但是是否包括境外已上市境内未上市药品(化学药5.1类,预防/治疗用生物制品3.1和3.2类)目前业内讨论比较广泛。
(本文仅代表作者个人观点,与其所在单位无关。)
注释
• [1]金杜知识产权保护蓝皮书——《各国专利链接制度比较研究以及在我国建立专利链接制度探讨》,邰红等,2020.4
责任编辑:研究会秘书处


 公众号二维码
公众号二维码